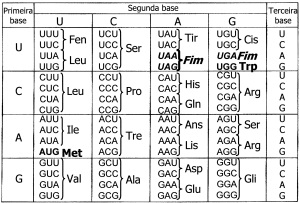
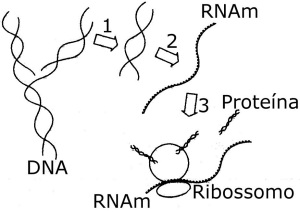
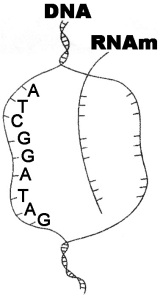
01. (UFV) A sequência de nucleotídeos 5′ …… UACCUAAUC …… 3′ de um mRNA irá codificar para qual peptídio?
a) –Tir–Leu–Ile–.
b) –Leu–Ile–His–.
c) –Cis–Leu–Ile–.
d) –Cis–Ile–His—.
02. (UFV) A sequência de nucleotídeos 3′ …… UACCUAAUC …… 5′ de um mRNA irá codificar para qual peptídeo?
a) –Tir–Leu–Ile–.
b) –Leu–Ile–His–.
c) –Cis–Leu–Ile–.
d) –Cis–Ile–His—.
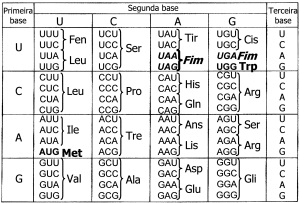
03. (UFMS) O código genético é perfeitamente conhecido, ou seja, os códons do DNA que codificam os aminoácidos presentes nas proteínas a serem sintetizadas, bem como algumas trincas que não codificam nenhum aminoácidos, são conhecidos. Na tabela a seguir, são mostrados alguns exemplos do código genético.
SEQUÊNCIA DO DNA
|
AMINOÁCIDO
|
GAA
| Leucina (Leu) |
TAA
| Isoleucina (Ile) |
AGA
| Serina (Ser) |
TAC
| Metionina (Met) |
CAC
| Valina (Val) |
GGG
| Prolina (Pro) |
AAA
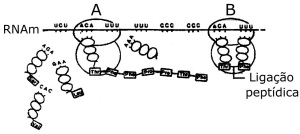
| Fenilalanina (Fen) |
CGA
| Alanina (Ala) |
CCG
| Glicina (Gli) |
ATA
| Tirosina (Tir) |
TGA
| Treonina (Tre) |
TTA
| Asparagina (Asn) |
GTA
| Hisitidina (His) |
CTA
| Ácido aspártico (Asp) |
GTT
| Glutamina (Gln) |
GCA
| Arginina (Arg) |
CTC
| Ácido glutâmico (Glu) |
ACA
| Cisteína (Cis) |
TTC
| Lisina (Lis) |
ACC
| Triptofano (Trp) |
ATT
| Sem sentido |
ACT
| Sem sentido |
Considerando a relação DNA/RNA mensageiro e os dados da tabela acima, é correto afirmar que:
I II
0 0 – Se a substituição da décima base nitrogenada de um DNA, que tem a sequência de bases correspondentes à sequência de aminoácidos Leu-Pro-Gli-Val-Ile, levou à substituição de um desses aminoácidos pela metionina, o aminoácido substituído foi a valina.
1 1 – Se a substituição da base intermediária em um determinado códon do gene para hemoglobina normal leva também à substituição do aminoácido original, esses aminoácidos podem corresponder ao ácido glutâmico (na hemoglobina normal) e à valina (na hemoglobina alterada).
2 2 – A substituição da vigésima-quarta base nitrogenada na sequência de códons AAA CGA TGA GTA GTA GTT CTC ATA ACC TTC CTC, por um base timina, resultará na produção de um polipeptídio Fen-Ala-Tre-His-His-Gln-Glu.
3 3 – A tradução de um RNA mensageiro com a sequência de bases GGC CGU CUU UCU UUU GAG GAU UGU UGG AUU resultará no polipeptídio composto pelos aminoácidos Gli-Arg-Leu-Ser-Fen-Glu-Asp-Cis-Trp-Ile.
4 4 – O número de aminoácidos presentes em um polipeptídio depende do número de códons do RNA mensageiro que o sintetiza.
04. (UEMA) O código genético é um sistema de informações bioquímicas que permite a produção de proteínas, as quais determinam a estrutura das células e controlam todos os processos metabólicos. Marque a alternativa correta em que se encontra a estrutura do código genético.
a) Uma sequência aleatória de bases nitrogenadas A, C, T, G.
b) Uma sequência de trincas de bases do DNA indica uma sequência de nucleotídeos que devem se unir para formar uma proteína.
c) Uma sequência de trincas de bases do RNA indica uma sequência de aminoácidos que devem se unir para formar uma proteína.
d) Uma sequência aleatória de bases nitrogenadas A, C, U, G.
e) Uma sequência de trincas de bases do DNA indica uma sequência de aminoácidos que devem se unir para formar uma proteína.
05. (UFPB) Os antibióticos são de extrema importância para o combate a muitas doenças causadas por bactérias. No entanto, o seu uso indiscriminado pode trazer graves problemas de saúde pública, a exemplo do surgimento das bactérias multirresistentes, como a KPC. Uma classe muito importante de antibióticos tem sua eficácia por agir no ribossomo da célula bacteriana, impedindo o funcionamento correto desse componente celular. Diante do exposto, é correto afirmar que essa classe de antibiótico é eficaz porque:
a) Impede a transcrição gênica.
b) Modifica o código genético.
c) Destrói a membrana plasmática.
d) Impede a síntese de proteínas.
e)Provoca mutações gênicas.
06. (MACK) Os códons UGC, UAU, GCC e AGC codificam, respectivamente, os aminoácidos cisteína, tirosina, alanina e serina; o códon UAG é terminal, ou seja, indica a interrupção da tradução. Um fragmento de DNA, que codifica a sequência serina – cisteína – tirosina – alanina, sofreu a perda da 9a base nitrogenada. Assinale a alternativa que descreve o que acontecerá com a sequência de aminoácidos.
a) O aminoácido tirosina será substituído por outro aminoácido.
b) O aminoácido tirosina não será traduzido, resultando numa molécula com 3 aminoácidos.
c) A sequência não será traduzida, pois essa molécula de DNA alterada não é capaz de comandar esse processo.
d) A tradução será interrompida no 2o aminoácido.
e) A sequência não sofrerá prejuízo, pois qualquer modificação na fita de DNA é imediatamente corrigida.
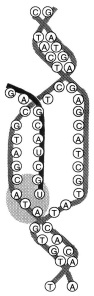
07. (FUVEST) Uma mutação, responsável por uma doença sanguínea, foi identificada numa família. Abaixo estão representadas sequências de bases nitrogenadas, normal e mutante; nelas estão destacados o sítio de início da tradução e a base alterada.
O ácido nucleico representado acima e o número de aminoácidos codificados pela sequência de bases, entre o sítio de início da tradução e a mutação, estão corretamente indicados em:
a) DNA; 8.
b) DNA; 24.
c) DNA; 12.
d) RNA; 8.
e) RNA; 24.
08. (UFT) As atividades celulares são orientadas pelas informações contidas no DNA, que são decodificadas em proteínas através dos mecanismos de transcrição e tradução. O que faz uma baleia parecer uma baleia são suas proteínas. Assim, as proteínas determinam as funções vitais da baleia, como de todos os seres vivos. Para ditar o desenvolvimento de um organismo, a informação do DNA deve, de algum modo, ser convertidaem proteínas. Essaconversão ocorre porque o DNA contém um código genético para os aminoácidos que compõem as proteínas. Nesse código, cada aminoácido é representado por uma sequência de pares de bases, e essa sequência é refletida na sequência de aminoácidos reunidos em uma cadeia proteica. Assim, traduzir o código genético significa passar o código de sequência de bases para uma sequência de aminoácidos. Desse modo, o DNA é decodificado na forma de uma proteína estrutural ou enzimática que, por sua vez, é responsável por uma característica do organismo.
Podemos afirmar que:
I. Essa decodificação se faz através da leitura de sequências de três nucleotídeos, chamados códons, que especificam aminoácidos.
II. Os códons diferem entre diferentes táxons de seres vivos; há códons que não codificam aminoácidos.
III. A decodificação ocorre no citoplasma celular, em estruturas chamadas ribossomos, a partir de uma fita simples de DNA que deixa momentaneamente o núcleo somente para tal função.
IV. Cada códon traduz apenas um aminoácido.
V. Alguns aminoácidos são codificados por mais de um códon. A isto chamamos degeneração do código, o que possivelmente traz maior estabilidade contra mutações no DNA.
Indique a alternativa em que todas as afirmativas são falsas.
a) I e III.
b) II, III e IV.
c) II e III.
d) II, III e V.
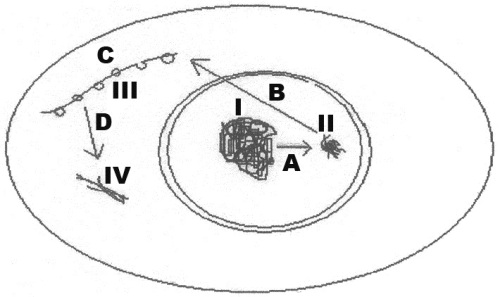
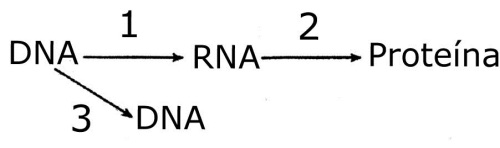
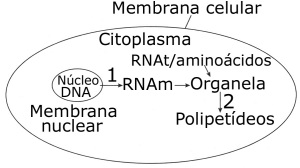
09. (URCA)Observe o esquema abaixo relativo ao processo de saída de informações genéticas do núcleo para o citoplasma e o processo de síntese proteica e responda corretamente:
a) I é o DNA e A é o processo de tradução.
b) II é o RNA e C é o processo de transcrição.
c) III é uma proteína e D é o processo de tradução.
d) IV é uma proteína e C é o processo de síntese.
e) I é uma proteína e A é o processo de duplicação do DNA.
10. Assinale a(s) alternativa(s) correta(s).
I II
0 0 – Utilizando bacteriófago cujo ácido nucleico estava marcado com P32 e cujos constituintes proteicos estavam marcados com S35, foi demonstrado que a proteína não tem função genética.
1 1 – Admitindo-se que as duas cadeias de uma molécula de DNA separem-se e que cada uma delas seja utilizada como molde para a formação de uma molécula de RNA mensageiro, teremos a síntese de duas cadeias proteicas diferentes.
2 2 – A produção de uma proteína específica, numa célula normal, é regulada diretamente pelo RNAr.
3 3 – O RNAm tem a propriedade de reconhecer a informação genética contida no RNAr, para a síntese de uma dada proteína, sendo este fenômeno que permite a associação do RNAm aos ribossomos.
4 4 – O RNAt, após se ligar ao aminoácido que lhe corresponde, reconhece no RNAr a sequência que o codifica.
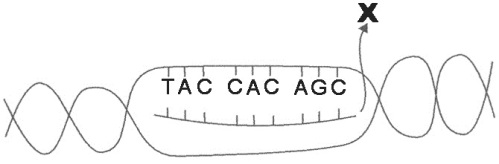
11. (UNCISAL) Observe o esquema que representa de forma resumida uma etapa da síntese proteica que ocorre em uma célula eucariótica.
Pode-se afirmar que a molécula indicada pela letra X corresponde ao:
a) DNA e a sua sequência de códons seria ATG GTG TCG.
b) DNA e a sua sequência de códons seria AUG GUG UCG.
c) RNA mensageiro e a sua sequência de códons seria ATG GTG TCG.
d) RNA mensageiro e a sua sequência de códons seria AUG GUG UCG.
e) RNA transportador e a sua sequência de anticódons seria UAG GUG UCG.
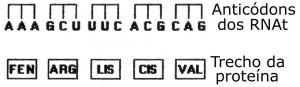
12. (PUCCAMP) O esquema a seguir representa a sequência de aminoácidos de um trecho de uma cadeia proteica e os respectivos anticódons dos RNA transportadores.
Assinale a alternativa que contém a sequência de códons do RNA mensageiro que participou dessa tradução.
a) UUU CGT TTG UGC GUC.
b) UUU CGA AAG UGC GUC.
c) TTT CGT TTC TGC GTC.
d) TTT CGA AAG TGC GTC.
e) CCC TAC CCA CAT ACT.
13. (UFPI) Com relação à síntese de proteínas em uma célula, assinale a(s) alternativa(s) correta(s).
I II
0 0 – Todas as células sintetizam os mesmos tipos de proteínas, nas mesmas proporções.
1 1 – A sequência de bases nitrogenadas, ao longo da molécula de RNAm determina a sequência dos aminoácidos incorporados na cadeia polipeptídica.
2 2 – Durante a síntese proteica, o RNAt tem por função levar os aminoácidos às mitocôndrias.
3 3 – As mitocôndrias não têm relação alguma com a síntese de proteínas, já que ocorre nos ribossomos.
4 4 – Um RNAm sintético que contenha apenas um determinado tipo de códon em sequência, condicionará a síntese de uma cadeia polipeptídica com um único tipo de aminoácido.
14. (CEFET-CE) A tabela abaixo representa a sequência de aminoácidos de um trecho de uma cadeia proteica e os respectivos anticódons dos RNA transportadores.
AAG
|
AAC
|
AUG
|
GGA
|
GCG
| Trecho do RNA-t |
Fen
|
Leu
|
Tir
|
Pro
|
Arg
| Trecho da cadeia proteica |
A altenativa que contém a sequência de códon do RNA mensageiro que participou dessa tradução é:
a) UUC UUG UAC CCU CGC.
b) UUA AAC AUG CCA AGA.
c) TTG TTC TTC CCT TCT.
d) TTC TTG TAC CCT UCU.
e) AAG AAC AUG GGA GCG.
15. (CEDERJ) Os polissomos são formados basicamente por uma molécula de RNAm (RNA mensageiro), associada a um determinado número de ribossomos. Nas células eucarióticas, os polissomos podem ser encontrados livres no citoplasma ou ligados à membrana do retículo endoplasmático. Quantos tipos de proteína, em um polissomo livre formado com oito ribossomos, serão sintetizados nos eucariotos?
a) Um.
b) Dois.
c) Quatro.
d) Oito.
16. Assinale a(s) alternativa(s) correta(s).
I II
0 0 – No esquema abaixo, os fenômenos de transcrição e tradução estão representados, respectivamente, pelos números 1 e 2.
1 1 – As ligações existentes entre os aminoácidos ocorrem entre o grupo amino de um aminoácido e o grupo carboxílico do outro aminoácido.
2 2 – Um peptídeo que apresente cem aminoácidos terá cem ligações peptídicas.
3 3 – Considerando uma proteína formada por 150 aminoácidos, o RNA mensageiro envolvido na sua síntese deverá conter, pelo menos, 300 nucleotídeos.
4 4 – A ocitocina é um polipeptídio constituído por oito aminoácidos, dispostos na sequência abaixo:
Pressupondo-se que os RNAt que atuam na síntese desse hormônio tenham a seguinte codificação:
Tirosina – UAC
Ácido glutâmico – GAG
Cisteína – UGC
Prolina – CCU
Ácido aspártico – GAU
Leucina – UUA
Glicina – GGU
Isoleucina – AUG
O DNA responsável pela síntese da ocitocina deve apresenta a seguinte sequência detriplets: TAC – CCT – GAG – GAT – GGT – TGC – TTA – ATG.
17. (UNIMEP-SP) Foram analisadas duas proteínas, X e Y, extraídas de órgãos diferentes de um macaco. Verificou-se que X apresenta 12 alaninas, 5 ácidos glutâmicos, 8 fenilalaninas, 2 lisinas e 10 glicinas, enquanto Y apresenta 12 alaninas, 5 ácidos glutâmicos, 8 fenilalaninas, 2 lisinas e 10 glicinas. Com relação a essa análise, podemos afirmar que:
a) X e Y são iguais, pois ambas possuem 37 aminoácidos.
b) X e Y são iguais, pois pertencem ao mesmo animal.
c) X e Y são diferentes, pois pertencem a órgãos diferentes.
d) X e Y são iguais, pois possuem os mesmos aminoácidos nas mesmas proporções.
e) Com esses dados não podemos dizer se X e Y são iguais ou diferentes.
18. (COVEST) As proposições a seguir são relativas ao processo de síntese de proteínas nas células vivas.
I II
0 0 – A molécula de DNA transcreve no núcleo uma molécula de RNA mensageiro (RNAm) com várias sequências de três bases – os códons.
1 1 – Cada códon do RNA mensageiro determinará a colocação de um aminoácido específico na cadeia polipeptídica.
2 2 – No local onde houver um ribossomo, pequenas moléculas de RNA transportador (RNAt), ligadas a aminoácidos, unem-se ao RNAm por uma sequência de três bases – o anticódon.
3 3 – O processo de síntese de proteínas ao nível do citoplasma é também conhecido como transcrição genética.
4 4 – Os diversos aminoácidos unem-se através de ligações do tipo éster, dando formação, ao final da leitura do RNAm, a uma proteína funcional.
19. (UFRN) Uma proteína X codificada pelo gene Xp é sintetizada nos ribossomos, a partir de um RNAm. Para que a síntese aconteça, é necessário que ocorram, no núcleo e no citoplasma, respectivamente, as etapas de:
a) Iniciação e transcrição.
b) Iniciação e terminação.
c) Tradução e terminação.
d) Transcrição e tradução.
20. Assinale a(s) alternativa(s) correta(s).
I II
0 0 – Na síntese proteica, o RNA mensageiro tem por função, levar do núcleo aos ribossomos, o padrão de orientação para síntese.
1 1 – Na presença de estreptomicina a célula produz enzimas e outras proteínas que não funcionam, devido à introdução de erros de interpretação a partir de códons do RNA mensageiro, ao nível dos ribossomos. Com base no exposto, podemos dizer que a estreptomicina determina erros na transcrição do código genético.
2 2 – Cada espécie produz aminoácidos específicos, o que lhe permite sintetizar proteínas específicas.
3 3 – Considerando-se: síntese de RNA mensageiro (I), síntese de celulose (II) esíntese de proteínas (III), a sequência dos três eventos é I – III – II.
4 4 – Em se tratando de um vírus cujo material genético é o RNA, este ácido nucleico induz o DNA da célula parasitada a produzir proteínas e ácidos nucleicos dos vírus.
21. (COVEST) O fenômeno mostrado na figura abaixo é denominado:
a) Duplicação do DNA.
b) Transcrição gênica.
c) Tradução do RNA viral.
d) Permutação genética.
e) Reparo do DNA viral.
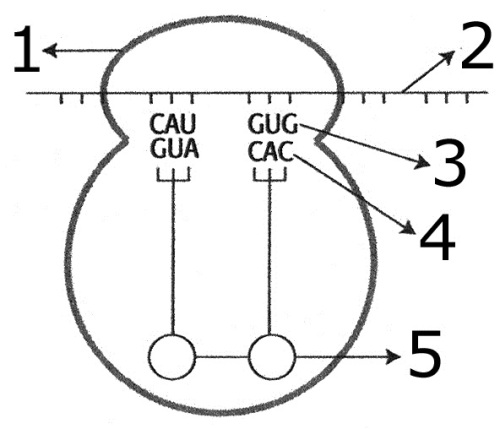
22. (UNIP-SP) No desenho abaixo aparece uma das etapas da síntese de proteínas.
Assinale a alternativa que, corretamente, identifica as estruturas numeradas de 1 a 5:
| |
RIBOSSOMO
|
AMINOÁCIDO
|
CÓDON
|
RNAm
|
ANTICÓDON
|
a
|
1
|
2
|
3
|
4
|
5
|
b
|
1
|
5
|
4
|
2
|
3
|
c
|
1
|
5
|
3
|
2
|
4
|
d
|
5
|
1
|
2
|
4
|
3
|
e
|
2
|
1
|
3
|
5
|
4
|
23. Assinale a(s) alternativa(s) correta(s).
I II
0 0 – No esquema a seguir, os fenômenos 1, 2 e 3, representam, respectivamente, duplicação, transcrição e tradução.
1 1 – Um RNAt transporta sempre um determinado aminoácido. Este aminoácido, qualquer que seja ele, pode ser transportado por diferentes RNAt.
2 2 – A RNA polimerase participa da quebra das pontes de hidrogênio na molécula de DNA.
3 3 – O número de aminoácidos presentes em um peptídeo depende do número de códons do RNAm que o sintetiza.
4 4 – Sintetizando-se in vitro uma molécula de proteína, nas mesmas condições que o processo ocorre nas células, utilizando-se ribossomos obtidos de células de rato, RNAm de células de sapos, RNAt de células de coelhos e aminoácidos ativados de células bacterianas, a proteína produzida teria a estrutura primária idêntica a da bactéria.
24. (UEL) Para síntese de uma determinada proteína, são necessários RNA mensageiro, RNA ribossômico, RNA transportador e aminoácidos. Sobre o assunto, considere as seguintes afirmativas:
I. A tradução ocorre no citoplasma da célula.
II. O RNA transportador carrega a mensagem para a produção da proteína.
III. Cada 3 nucleotídeos do RNA mensageiro determinam a colocação de um aminoácido específico na proteína.
IV. Moléculas de RNA transportador, ligadas a aminoácidos, unem-se ao RNA ribossômico por um sequência de 3 bases.
V. Enquanto o ribossomo se desloca sobre a fita de RNA mensageiro, outros RNA transportadores se encaixam, trazendo novos aminoácidos.
Assinale a alternativa correta.
a) Apenas as afirmativas I e II são corretas.
b) Apenas as afirmativas I, III e V são corretas.
c) Apenas as afirmativas II e V são corretas.
d) Apenas as afirmativas I, II, IV e V são corretas.
e) Apenas as afirmativas III e V são corretas.
25. (UNESP) Considere o diagrama abaixo, que resume as principais etapas da síntese proteica que ocorre numa célula eucarionte.
Os processos assinalados como 1 e 2 e a organela representados no diagrama referem-se, respectivamente, a:
a) Transcrição, tradução e ribossomo.
b) Tradução, transcrição e lisossomo.
c) Duplicação, transcrição e ribossomo.
d) Transcrição, duplicação e lisossomo.
e) Tradução, duplicação e retículo endoplasmático.
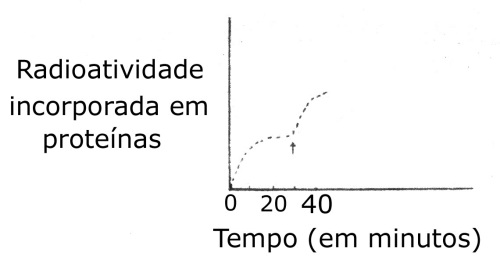
26. (UERJ) A biossíntese de proteínas pode ser estudada in vitro, com o emprego de extratos bacterianos. Em uma experiência deste tipo, após rotura das bactérias e adição de ADNase (visando destruir o DNA bacteriano) acrescentou-se ATP, GTP (guanosina-trifosfato) e leucina C14. Em seguida, foi adicionado um tipo de RNA mensageiro, sendo iniciadas as marcações de tempo (instante zero do gráfico abaixo). Mediu-se o acréscimo de radioatividade na fração de proteínas sintetizadas após adição dos mensageiros e, quando a síntese de proteínas começou a parar (no instante assinalado pela seta), adicionou-se mais RNA mensageiro, continuando-se a medir o acréscimo de radioatividade na proteína.
Como você interpretaria esta experiência?
a) A síntese de proteínas parou, antes da adição de mais RNA mensageiro, como consequência do esgotamento do aminoácido marcado.
b) A síntese de proteínas é independente da quantidade de mensageiro, só dependendo da adição de ATP, GTP e aminoácidos marcados.
c) A velocidade de formação de proteínas decresce à proporção que o RNA mensageiro sofre degradação.
d) Todas as moléculas de RNA mensageiro perdem sua atividade biológica em menos de um minuto.
e) O bloqueio da formação de proteínas é consequência da destruição dos ribossomos.
27. (COVEST) No esquema abaixo, relativo à síntese proteica, I, II, III e IVrepresentam, respectivamente:
a) RNAt, RNAm, anticódon, códon.
b) Códon, anticódon, RNAt, RNAm.
c) RNAm, RNAt, anticódon, códon.
d) RNAt, RNAm, anticódon, códon.
e) RNAm, polimerase, códon, anticódon.
28. (UPE) O esquema a seguir, representa a maquinaria celular de síntese proteicaem funcionamento. Porsua análise, podemos chegar a algumas conclusões. Assinale, na coluna I, aquelas que estão corretas e, na coluna II, as que estão erradas.
I II
0 0 – O ribossomo B está iniciando o processo de tradução, portanto, a síntese está correndo da direita para a esquerda, sob ação da RNA polimerase.
1 1 – Os RNAt do complexo B são reconhecidos pelo RNAm devido a seus anticódonsAAA e UGU.
2 2 – Sendo a sequência dos aminoácidos, no polipeptídio neoformado, correspondente à sequência de códons no RNAm, o oitavo aminoácido a entrar na cadeia será a SERINA.
3 3 – O segmento de RNAm apresentado no esquema resultou da transcrição de um segmento de DNA – 5’AAATGTGGGGGGTTTTTTUGUGAG3′.
4 4 – Os aminoácidos fenilalanina, treonina e prolina são especificados por mais de um códon no RNAm, logo reconhecidos por mais de um RNAt. Concluímos daí, que o produto do complexo B poderá ser diferente daquele produzido pelo complexo A.
29. (UNIFICADO) Admitamos que pesquisadores tenham verificado que um ácido nucleico, formado por 1.000 nucleotídeos, de uma espécie de vírus, modela a síntese de duas proteínas diferentes, uma com 300 aminoácidos e outra com 200 ácidos aminados. A explicação provável para o que acontece é a seguinte:
a) Nesta espécie de vírus, cada tipo de aminoácido é reconhecido por um par de nucleotídeos.
b) Nesta espécie de vírus, cada tipo de ácido aminado é reconhecido por determinado tipo de nucleotídeo, podendo, portanto, o seu ácido nucleico modelar ainda outras proteínas.
c) Nesta espécie de vírus, as proteínas são modeladas pelo ácido nucleico e também por outras proteínas do próprio vírus.
d) Nesta espécie de vírus, um dado trecho de ácido nucleico pode servir para sintetizar duas proteínas, uma vez que os pontos de partida das sínteses são diferentes.
e) O ácido nucleico desse vírus não é estável, podendo, por isso, um dado trecho modelar mais de um tipo de proteínas.
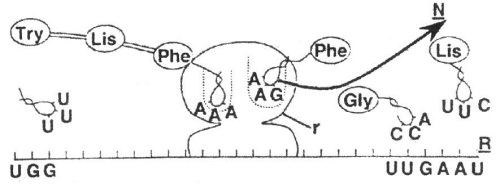
30. (COVEST) Observando a figura abaixo, que representa o processo de síntese de uma proteína, avalie as proposições e assinale a(s) correta(s).
I II
0 0 – O RNA-m (R) foi transcrito no núcleo, a partir de um segmento de DNA que corresponde a uma determinada proteína (segmento chamado cístron) e migrou para o citoplasma associando-se a um ribossomo (r).
1 1 – As trincas de nucleotídeos na fita de DNA que deram origem às duas moléculas de fenilalanina, com certeza, são formadas pelas sequências de bases AAA eAAG; enquanto os códons do RNA-m que codificam para esses aminoácidos são TTT eTTC, respectivamente.
2 2 – Conforme o códon que possui, o RNA-t (N) transporta um aminoácido específico.
3 3 – A partir da sequência de bases nas moléculas de RNA-t de fenilalanina podemos concluir que o código genético é degenerado.
4 4 – Ao conjunto de eventos representados, que ocorre em nível do ribossomo, chamamos tradução.
31. (FATEC-SP) Alguns antibióticos, como a eritromicina e o cloranfenicol, são utilizados no tratamento de doenças infecciosas, pois têm a capacidade de bloquear a síntese de proteínas nas bactérias, sem interferir nas células afetadas ou contaminadas. Com base nessas informações, é correto concluir que esses antibióticos atuam nas bactérias:
a) Provocando a plasmólise das células.
b) Impedindo a transcrição do DNA nuclear.
c) Impedindo a transcrição ou a tradução no hialoplasma.
d) Como agentes mutagênicos do DNA mitocondrial.
e) Impedindo que os ribossomos aderidos ao retículo endoplasmático atuem na montagem das proteínas.
32. Três tipos de RNA participam da síntese de uma proteína específica: RNA mensageiro (m-RNA), RNA ribossomal (r-RNA) e RNA transportador (t-RNA). O estudo de suas funções permite afirmar que:
a) O r-RNA não é codificado pelo DNA.
b) Devem existir, pelo menos, tantas espécies de t-RNA quantas são as espécies de aminoácidos encontrados nas proteínas celulares.
c) O m-RNA tem a propriedade de reconhecer a informação genética para a síntese de proteínas contida no r-RNA, o que permite sua associação aos ribossomas.
d) O t-RNA, após receber o ácido aminado que lhe corresponde, reconhece, no r-RNA, a sequência que o codifica.
e) Há acima mais de um item correto.
33. (UNEB) Dada uma lista de ácidos nucleicos e outra com suas funções são corretas as associações:
I. RNA-t
II. RNA-m
III. RNA-r
IV. DNA
A. Comanda todo o funcionamento da célula; transmite a informação genética para as outras células.
B. Transporta os aminoácidos unindo o seu anticódon ao códon de um dos tipos de RNA.
C. Através da sequência de suas bases, determina a posição dos aminoácidos nas proteínas.
D. Combina-se com um dos tipos de RNA para formar os polirribossomos.
a) I-B; II-C; III-A; IV-D.
b) I-C; II-D; III-A; IV-B.
c) I-D; II-B; III-A; IV-C.
d) I-C; II-B; III-D; IV-A.
e) I-B; II-C; III-D; IV-A.
34. (UEG) Estudando o processo de síntese proteica in vitro, Chapeville e colaboradores verificaram que, por tratamento químico do complexo aminoácido-RNAt correspondente à cisteína (cisteinil-RNAt), é possível transformar este aminoácido em alanina, sem dissociá-lo do RNAt e sem afetar as características intrínsecas deste RNA. Obtém-se, dessa maneira, um complexo “híbrido” que, adicionado ao sistema de síntese de proteínas in vivo, promove a incorporação de alanina, no lugar da cisteína, no polipeptídeo sintetizado. A experiência é interpretada como indicativa de que:
a) A seleção do ácido aminado a ser integrado na sequência polipeptídica é determinada pela constituição química do ácido aminado.
b) O RNAt serve apenas como transportador do ácido aminado e não intermediário de sua integração correta na sequência polipeptídica.
c) Qualquer tipo de complexo aminoacil-RNAt pode se associar ao ribossoma, em qualquer etapa da síntese do polipeptídeo.
d) O reconhecimento, pelo RNAt, de um determinado códon do RNA mensageiro não depende do aminoácido.
e) O anti-códon do RNAt para cisteína é idêntico ao anti-códon do RNAt para alanina.
35. (PUC-SP) Duas espécies (A e B) apresentam a seguinte diferença na porção terminal de uma dada proteína, envolvendo três aminoácidos:
ESPÉCIE A
|
ESPÉCIE B
|
| ARGININA-LEUCINA-PROLINA | LEUCINA-LEUCINA-LEUCINA |
Analisando o RNA mensageiro codificador dessa proteína, pode-se supor que a espécieA se diferencia da B em relação a:
a) 2 códons.
b) 3 códons.
c) 9 códons.
d) 3 bases nitrogenadas.
e) 9 bases nitrogenadas.
36. (CESGRANRIO) Os ribossomos, partículas citoplasmáticas de 15 a 25 nm de diâmetro, compostas de ARN e proteínas estão envolvidos diretamente na síntese de proteínas citoplasmáticas e de proteínas para exportação pela célula. As três afirmativas abaixo se referem à estrutura e à função dessas organelas.
I. Os ribossomos são formados por três subunidades compostas por ARN e proteínas de diferentes pesos moleculares.
II. No processo de síntese e transferência de proteínas para o retículo endoplasmático granular, o ribossomo se prende, à membrana do mesmo, através da subunidade menor.
III. Os polissomos, formados por ribossomos e ARN mensageiro, representam formas ativas no processo de síntese proteica.
Assinale:
a) Se somente I for correta.
b) Se somente II for correta.
c) Se somente III for correta.
d) Se somente II e III forem corretas.
e) Se I, II e III forem corretas.
37. (UERJ)O bacteriófago T2 tem como material genético uma molécula de DNA com cerca de 3.600 nucleotídeos, que compreendem três genes. Admitindo-se que esses três genes tenham aproximadamente as mesmas dimensões e que a massa molecular média dos aminoácidos seja igual a 120, cada uma das proteínas por eles codificados deve ter uma massa molecular aproximada de:
a) 4.800.
b) 24 x 103.
c) 4 x 102.
d) 12.000.
e) 144 x 103.
38. (COVEST) A molécula de RNAm é sintetizada no núcleo, transcrevendo a sequência de bases de uma cadeia de DNA. O RNAmno citoplasma se liga ao ribossomo, onde se dá a produção de cadeias peptídicas. Considerando esse tema, analise a figura e as proposições a seguir.
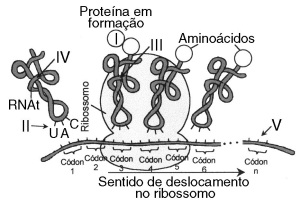 I II
I II
0 0 – O aminoácido metionina (I) é trazido ao ribossomo pelo RNAt cujo anticódon é UAC (II), complementar ao códon AUG do RNAm.
1 1 – Na etapa seguinte da tradução, um segundo RNAt (III), cujo anticódon é complementar ao segundo códon do RNAm geralmente onde há uma trinca UAA, UAG ou UGA, encaixa-se no sítio destinado à entrada de aminoácidos na cadeia peptídica.
2 2 – Quando se estabelece uma ligação peptídica entre os dois primeiros aminoácidos, o RNAtdo primeiro aminoácido é liberado (IV) no citoplasma.
3 3 – O final da tradução ocorre quando, na leitura da mensagem genética, se chega a um códon de parada (V), a saber, UUG, UUA ou GUA, para os quais não há aminoácido correspondente.
4 4 – 61 códons correspondem aos aminoácidos que compõem as proteínas. Sabendo-se que os códons 5 e 6 trazem a informação para um mesmo aminoácido, para o qual existe apenas uma trinca de codificação, podemos afirmar que os códons 5 e 6codificam, ou para a metionina ou para o triptofano.
39. (CESCEA) Na interfase, uma nova fita complementar de DNA é formada a partir de uma antiga, que apresenta a seguinte sequência de bases nitrogenadas:CATGCTTAC. Admitindo-se que a transcrição é feita da nova cadeia para o RNA mensageiro, este deverá apresentar a seguinte sequência de bases:
a) GTACGAATG.
b) GATGCTTAC.
c) CTUGCUUTC.
d) CAUGCUUAC.
e) GUACGAAUG.
40. (COVEST) As proposições a seguir referem-se à síntese proteica. Analise-as.
I II
0 0 – O RNAr transmite a informação genética às células.
1 1 – Na mitocôndria ocorre síntese proteica.
2 2 – O RNAm, através da sequência de suas bases, determina a posição dos aminoácidos nas proteínas.
3 3 – As sequências de aminoácidos, na cadeia polipeptídica, são identificadas pelo RNAr.
4 4 – Os polissomos constituem formas ativas no processo da síntese proteica.
41. (UNIFOR) “O RNA mensageiro é produzido no ____I___ e, ao nível ____II___ , associa-se a ____IIII___ participando das síntese de ____IV___ .” Para completar corretamente essa frase, I, II, III e IV devem ser substituídos, respectivamente, por:
a) ribossomo – citoplasmático – mitocôndrias – energia.
b) ribossomo – citoplasmático – mitocôndrias – DNA.
c) núcleo – citoplasmático – mitocôndrias – proteínas.
d) citoplasma – nuclear – ribossomos – DNA.
e) núcleo – citoplasmático – ribossomos – proteínas.
42. (Olimpíada de Biologia)Um RNAm de bactéria com exatos 360 nucleotídeos de tamanho irá codificar uma proteína de:
a) Aproximadamente 360 aminoácidos.
b) Aproximadamente 1080 aminoácidos.
c) Exatos 120 aminoácidos.
d) Menos do que 120 aminoácidos.
e) Mais do que 120 aminoácidos.
43. (FUVEST) O código genético está todo decifrado, isto é, sabe-se quais trincas de bases no DNA correspondem a quais aminoácidos nas proteínas que se formarão.
SEQUÊNCIA DO DNA
|
AMINOÁCIDO
|
AGA
|
serina (SER)
|
CAA
|
valina (VAL)
|
AAA
|
fenilalanina (FEN)
|
CCG
|
glicina (GLI)
|
AAT
|
leucina (LEU)
|
GAA
|
leucina (LEU)
|
Com base na tabela acima, assinale a(s) alternativa(s) correta(s).
I II
0 0 – Se um RNAm tem sequência de trincas UUAUUUCUUGUUUCUGGC, a sequência dos aminoácidos no polipeptídeo correspondente será: LEU – FEN – LEU – VAL – SER – GLI.
1 1 – Os anticódons dos RNAt da leucina serão AAU e GAA.
2 2 – O anticódon do RNAt da glicina será GGC.
3 3 – O anticódon do RNAt da valina será CAA.
4 4 – O anticódon do RNAt da serina será UCU.
44. (UFOP) Com relação à síntese de proteínas em uma célula, é incorreto afirmar:
a) Todas as células sintetizam sempre os mesmos tipos de proteínas, nas mesmas proporções.
b) A sequência de bases nitrogenadas ao longo da molécula de RNA mensageiro determina a sequência dos aminoácidos incorporados na cadeia polipeptídica.
c) Para a formação da proteína, não basta a atividade do RNAm; é necessária a participação dos RNAt e dos ribossomos.
d) Ao longo de um DNA, há segmentos que atuam diretamente na síntese de proteínas, os éxons, e os que parecem inativos nesse processo, os íntrons.
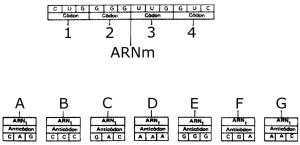
45. (FUND.CARLOS CHAGAS) O números 1, 2, 3 e 4 correspondem ao ARNm(mensageiro) e as letras A, B, C, D, E, F e G correspondem aos respectivos ARNt(transportador), indicando, resumidamente, um dos passos na síntese de proteínas.
Qual das alternativas abaixo expressa corretamente o mecanismo genético acima?
a) 1 – C, 2 – B, 3 – G, 4 – A.
b) 1 – D, 2 – A, 3 – F, 4 – C.
c) 1 – A, 2 – C, 3 – B, 4 – E.
d) 1 – B, 2 – D, 3 – A, 4 – F.
e) 1 – F, 2 – A, 3 – D, 4 – G.
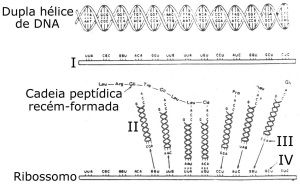
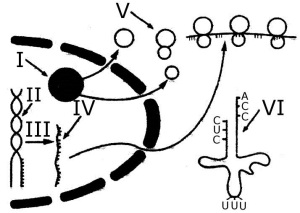
46. (UFV) Com base no esquema abaixo, que mostra alguns passos necessários à síntese proteica, bem como algumas moléculas e estruturas nela envolvidas, assinale a(s) alternativa(s) correta(s).
I II
0 0 – I representa o nucléolo.
1 1 – A etapa III é denominada transcrição.
2 2 – O complexo resultante da união de IV com V é chamado polirribossomo.
3 3 – VI atua no transporte dos aminoácidos.
4 4 – II está relacionado com a formação de V e de VI.
47. (PUC-SP) A rifampicina é um antibiótico que inibe a atividade da enzima responsável pela transcriçãoem bactérias. Seuma célula for tratada com esse antibiótico, deverá apresentar inibição:
a) Exclusivamente da produção de DNA.
b) Exclusivamente da produção de proteínas.
c) Da produção de DNA e de proteínas.
d) Da produção de RNA e de proteínas.
e) Da produção de DNA, de RNA e de proteínas.
48. A figura abaixo resume o processo de transcrição. A sequência de bases orgânicas do RNAm recém produzido é (de cima para baixo):
a) TAG – CCT – ATC.
b) TUC – CUT – AGA.
c) AUC – GGA – UAG.
d) ATC – UCT – TAG.
e) AUA – UAU – AAU.
49. (UECE) No processo de síntese proteica:
I. Há uma interrelação do núcleo com o citoplasma.
II. Os aminoácidos do citoplasma são selecionados pelo RNA-t (transportador) e vão formar o códon.
III. No mecanismo de tradução ou decodificação é imprescindível a participação dos ribossomos.
Assinale a alternativa
a) Se apenas I e III estiverem corretas.
b) Se apenas III estiver correta.
c) Se apenas I e II estiverem corretas.
d) Se I, II e III estiverem corretas.
50. (UEG) Vamos admitir que as duas cadeias de uma molécula de ADN separam-se e que cada uma delas vai servir de molde para a formação de uma molécula de ARN mensageiro. Se ocorrer, teremos o seguinte resultado:
a) Uma das moléculas de ARN mensageiro dirigirá a formação de um tipo de proteína e a outra molécula, um tipo diferente de proteínas.
b) As duas moléculas de ARN mensageiro dirigirão a formação de proteínas iguais.
c) As duas proteínas são iguais, mas não têm a mesma sequência de ácidos aminados.
d) As duas proteínas terão a mesma sequência de ácidos aminados, porque cabe aos ARN de transferência colocar os aminoácidos nos devidos lugares.
e) As duas proteínas serão diferentes, porque os ribossomos interpretarão corretamente as mensagens contidas nas moléculas de ARN mensageiro.
GABARITO
01
|
02
|
03
|
04
|
05
|
06
|
07
|
08
|
09
|
10
|
A
|
B
|
VVVVV
|
E
|
D
|
D
|
D
|
C
|
D
|
VVFFF
|
11
|
12
|
13
|
14
|
15
|
16
|
17
|
18
|
19
|
20
|
D
|
B
|
FVFFV
|
A
|
A
|
VVFFV
|
E
|
VVVFF
|
D
|
VFFVF
|
21
|
22
|
23
|
24
|
25
|
26
|
27
|
28
|
29
|
30
|
B
|
C
|
VFFVF
|
B
|
A
|
C
|
C
|
FVVFF
|
D
|
VFFVV
|
31
|
32
|
33
|
34
|
35
|
36
|
37
|
38
|
39
|
40
|
C
|
B
|
E
|
D
|
A
|
C
|
B
|
VFVFV
|
D
|
FVVFV
|
41
|
42
|
43
|
44
|
45
|
46
|
47
|
48
|
49
|
50
|
E
|
D
|
VVFVF
|
A
|
A
|
VVVVV
|
D
|
C
|
A
|
A
|